Jeg kobler sædet, mens Ferrari pludselig stopper ved et kryds og derefter kaster utålmodig indtil lyset skifter. Når det starter, føles brølen underligt ekstravagant for de stille gader i forstæder Columbus, Ohio.
Relateret indhold
- En triumf i krigen mod kræft
- Genterapi i et nyt lys
- De 'hemmelige jøder' i San Luis Valley
Chaufføren er Carlo Croce, en 64-årig italiensk videnskabsmand med en stor stemme, skævt krøllet hår og udtryksfulde mørke øjne. Han leder Human Cancer Genetics-programmet ved Ohio State University, og hans sølv Scaglietti Ferrari er et passende symbol på hans tilgang til videnskab: storslået, kraftig og især i disse dage, sydende.
Croce, der voksede op i Rom som det eneste barn af en maskiningeniørfar og en hjemmeværende mor, gik på medicinsk skole på Universitetet i Rom og kom til USA i 1970 for at studere kræft. ”Jeg troede, det var stedet at arbejde inden for videnskab, ” siger han. Croce var en af de første forskere, der konstaterede, at kræft - den løbende vækst af celler, der normalt holdes i kontrol - kan være forårsaget af genetiske ændringer. Han har identificeret bestemte genændringer, der er forbundet med kræft i lunger og spiserør samt med forskellige typer lymfom og leukæmi.
Kolleger siger, at Croce har bemærkelsesværdige videnskabelige instinkter. "Hvis du spreder fem ting foran ham, kan han næsten unerringly vælge den, der skal arbejde, " siger Webster Cavenee, direktør for Ludwig Institute for Cancer Research i San Diego. "Han kan lugte noget interessant, og han har næsten aldrig forkert."
Det var for et par år siden, at Croce begyndte at snuse ud en af de mest overraskende og mest lovende opdagelser inden for kræftforskning. Opdagelsen placerede ham og hans samarbejdspartnere i forkant af et nu blomstrende felt, der lover forbedrede teknikker til diagnosticering af sygdom og, håber de, mere effektive nye behandlinger. Faktisk er Croces seneste arbejde del af en helt ny måde at se på gener på, og hvordan livet regulerer sig selv. Hvilket gør det desto mere bemærkelsesværdigt, at hans indsigt først kom, efter at han og hans medarbejdere havde kørt i tophastighed ind i en blindgyde.
En af de herligheder i det 20. århundredes videnskab var opdagelsen i 1953 af strukturen af det genetiske materiale DNA; det er en lang stige-lignende polymer snoet ind i en dobbelt helix. Hver rung er en kæde af kemiske forbindelser, kaldet baser, og deres nøjagtige sekvens koder for genets instruktioner, ligesom bogstaverne i et ord. I løbet af årtierne førte bjerge af laboratoriebevis forskere til at foretage to grundlæggende antagelser om gener.
For det første er et gen relativt stort, typisk bestående af titusinder af kemiske baser i træk.
For det andet er det vigtigste job for et bestemt gen at instruere celler til at fremstille dets tilsvarende protein. Et protein er et stort, kompliceret molekyle, der udfører en bestemt funktion, afhængigt af hvordan det er lavet: det kan være en del af en muskelfiber eller et enzym, der fordøjer mad eller et hormon, der styrer fysiologi, blandt mange andre ting.
Bestemt Croce havde disse antagelser, da han i de tidlige 1990'ere begyndte at identificere et gen involveret i kronisk lymfocytisk leukæmi, eller CLL. Blodkræft fylder knoglemarv og lymfeknuder med kræftceller, der fortrænger raske celler i immunsystemet, hvilket efterlader kroppen mindre i stand til at bekæmpe infektion. Croce havde analyseret kræftceller fra mennesker med CLL og fandt, at mange manglede det samme lange segment af DNA. Et sted på det segment, begrundede han, var et gen, der var afgørende for at forhindre, at hvide blodlegemer blev kræft.
I næsten syv år holdt Croce og hans kolleger nulstilling af forskellige bits af den længe mistænkte DNA-streng, idet de omhyggeligt bestemte dens genetiske sekvens, base for base. De udførte også adskillige eksperimenter, der testede, om generne kunne forårsage CLL.
De slog ud. "Vi karakteriserede hvert blodigt gen, der var til stede i det DNA, og intet af det var genet", der er forbundet med CLL, husker Croce. "Jeg var meget frustreret." Det var hans studerende og samarbejdspartnere. ”Åh, jeg brændte nogle få menneskers liv, ” tilføjer Croce. En forsker afslutter videnskab helt for at få en grad i forretningsadministration.
I 2001 hyrede Croce George Calin, en rumænsk gastroenterolog, til at påtage sig det projekt, alle var vokset til at hade. ”Han havde intet værre i laboratoriet, ” joker Calin.
"Se, " sagde Croce til Calin, "genet skal være der."
Omkring den samme tid begyndte en ny forståelse af genetik at cirkulere. Mærkeligt nok blev det lettet af en mutantorm, der ikke var i stand til at lægge æg. Dyret mødte en forfærdelig skæbne: hundreder af æg rugede inde i kroppen, hvilket fik det til at briste åbent. Victor Ambros, udviklingsbiolog, derpå ved Harvard (nu ved University of Massachusetts Medical School), studerede mutationen, der var ansvarlig for ormens genetiske defekt. Ormen, Caenorhabditis elegans, er en mikroskopisk væsen, som genetikere elsker at studere, fordi den er let at dyrke - den spiser almindelige bakterier - og er gennemsigtig, så alle sine 900 celler kan observeres, når de udvikler sig. Mærkeligt nok, da Ambros søgte efter det muterede gen, blev sektionen, hvor det tilsyneladende skulle være, for lille til at indeholde et normalt gen. ”Det blev mindre og mindre tydeligt, at dette stykke DNA kunne kode et protein, ” siger han. "Det var temmelig forbløffende."
Over Charles River ved Massachusetts General Hospital studerede en molekylærbiolog ved navn Gary Ruvkun en anden C. elegans- mutant. Ambros og Ruvkun mistænkte begge, at genet Ambros ledte på en eller anden måde kontrollerede genet, der var gået forkert i Ruvkuns orme. Arbejdet med en længe besluttede de at sammenligne de to gener for at se, om de lignede hinanden.
"Vi mailede hinanden vores sekvenser, og vi blev enige om at kalde ind senere, hvis vi så noget, " husker Ambros. "En af os kaldte den anden, og jeg sagde: 'Gary, ser du det? Og han sagde:' Ja, jeg ser det! '" De havde fundet en perfekt match - et stykke DNA fra Ambros' korte genetiske sekvens identisk til et afsnit af Ruvkuns gen i normal størrelse.
Ambros 'gen var virkelig lille, kun 70 baser langt, ikke 10.000 baser som andre gener. Fremmed nok, genet producerede ikke et protein, som andre gener gør. I stedet lavede det en anden slags genetisk materiale, som nu kaldes microRNA. Traditionelle gener fremstiller også RNA, et molekyle, der ligner kemisk DNA, men at RNA er kortvarig og tjener som en blot messenger eller formidler i konstruktionen af proteiner. Men dette microRNA var genets slutprodukt, og det var ingen ren messenger.
MicroRNA, Ambros og Ruvkun indså, arbejdet med en spændende mekanisme: det fungerede som en miniatyrbånd af velcro. Da microRNA-genet stemte overens med en del af et traditionelt gen, blev mikroRNA fastgjort til RNA produceret af det traditionelle gen. Dermed blokerede det det andet gen fra at producere protein.
Det var et fascinerende fund, men de to videnskabsmænd troede, det var bare en underlighed, indtil syv år senere i 2000 fandt en forsker i Ruvkuns laboratorium, Brenda Reinhart, et andet microRNA-gen i ormen. "Det fortalte mig, at små RNA'er ville blive mere almindelige, end vi forventede, " siger udviklingsbiolog Frank Slack, der hjalp med opdagelsen i Ruvkuns laboratorium og nu er på Yale.
Ruvkun-laboratoriet begyndte på udkig efter mikroRNA-gener hos andre dyr. Da det skete, var det et godt tidspunkt at søge efter genetiske afvigelser. I 2001 afsluttede forskere et udkast til hele sekvensen af humant DNA, kendt som det humane genom, og de sekventerede hurtigt andre genomer, inklusive dem fra mus, sennepsplante, frugtflue og malaria-parasit. Nogle genomer blev ved at blive tilgængelige på internetdatabaser, og Ruvkun fandt det samme microRNA-gen fra C. elegans- ormen i frugtfluer og mennesker. Derefter fandt han genet i bløddyr, zebrafisk og andre arter. I mellemtiden fandt Ambros 'gruppe og andre snesevis af yderligere microRNA-gener.
Resultaterne var forbløffende - det er trods alt ikke hver dag, der opdages en ny klasse af gener - men det var ikke klart, hvilken rolle disse miniatyrgener kunne spille i folks liv.
Det var, da Carlo Croce og George Calin besluttede at tage et nyt blik på det mystiske tilfælde af det manglende leukæmi-gen. Calin, der nu er en molekylærbiolog ved University of Texas MD Anderson Cancer Center, indtastede de kendte mikroRNA-gensekvenser i sin computer og sammenlignede dem med den strækning af DNA, som mange CLL-patienters kræftceller mangler. ”De var nøjagtigt der, ” minder han om: to mikroRNA-gener sad lige, hvor det antages, at det CLL-undertrykkende gen var.
Calin kaldte Croce ind i laboratoriet med det samme: "Dr. Croce, dette er generne!"
Croce så på Calin og blinkede. ”S --- !, ” husker Calin ham og sagde. "Dette er generne! '"
Calin og Croce testede blodprøver fra leukæmipatienter og fandt, at 68 procent indeholdt lidt eller ingen af de to mikroRNA'er, mens blodlegemer fra mennesker uden kræft havde mange af molekylerne. Calin og Croce var overbeviste: disse to små gener lavede mikroRNA'er, der undertrykte kræft.
”Jeg var bedøvet, ” siger Croce. "Vi havde dogmen om, at alle kræftgenerne var proteinkodende gener, " siger Croce. MicroRNA "forklarede meget, som vi ikke kunne forklare før. Det ændrede den måde, vi kiggede på problemet på."
Calin og Croce offentliggjorde deres konstatering i 2002 - første gang nogen havde impliceret mikroRNA'er i menneskelig sygdom.
Siden da, "hver kræft, vi ser på, finder vi en ændring i microRNA, " siger Croce. "I sandsynligvis hver menneskelig tumor er der ændringer i microRNA."
Croce bor i en statelig palæ i Columbus 'Upper Arlington forstad. Hælder af e-mails er spredt på køkkenbordet, når vi ankommer. Croce har været væk hjemmefra i uger, deltaget på konferencer og holdt foredrag på National Institute of Health i Bethesda, Maryland, National Academy of Sciences i Washington, DC, et kræftmøde i San Diego, Johns Hopkins University i Baltimore og tre møder i Italien. Huset føles tomt og ubrugt.
”I det væsentlige er det bare for at sove, ” siger Croces søn, Roberto (29), senere om sin fars hus. "Han parkerer stort set bare sine ejendele der. Hvis han er i byen, er han på arbejde, eller han hænger ud med mig." Roberto arbejder mod en ph.d. i økonomi i Ohio State. (Carlo, der aldrig har giftet sig, har også en 12-årig datter, der bor i Buenos Aires.)
Inde i huset tager kunst, ikke videnskab, centrum. Croce ejer mere end 400 malerier af italienske mestere fra 16. til 18. århundrede. Han byggede en kavernøs 5.000 kvadratmeter stor vinge - 21 fods lofter og alt - for at vise nogle af de største malerier.
Croce siger, at han købte sit første maleri, da han var 12 år gammel, for $ 100. Han kan lide at købe malerier, når han har en mistanke om, hvem kunstneren er, men ikke ved med sikkerhed. ”Jeg spørger aldrig nogen, ” siger han. "Jeg køber bare det, og så har jeg måske forkert, eller jeg har måske ret." Han købte et maleri for $ 11.500 fra et galleri i Napoli. Han troede, det kunne være af en barokkmaler ved navn Bartolomeo Schedoni. "Jeg lavede et billede, efter at det blev gendannet, og sendte det til eksperten på Schedoni. Han sagde, 'Åh ja, det er Schedoni.'" Maleriet, siger Croce, er sandsynligvis 100 gange værd, hvad han betalte for det.
"Hans kunstsamling har den samme eksperimentelle bøjning, som hans videnskab har, " siger Peter Vogt, en kræftforsker ved Scripps Research Institute i La Jolla og en ven af Croce's.
I årenes løb har Croce patenteret flere opdagelser og co-grundlagt tre virksomheder. Hans laboratorium i Ohio State ligger på de to øverste etager i en bygning på ti etager. Med et personale på omkring 50 personer har laboratoriet et budget på omkring $ 5 millioner om året, hvilket er på niveau med et lille bioteknologisk firma. Hans finansiering kommer fra føderale og private tilskud.
"Der er mange mennesker, der ville sige, at han er helt succesrig, fordi han har en enorm mængde ressourcer. Jeg synes faktisk, det er omvendt; jeg tror, han har enorme mængder ressourcer, fordi han har succes, " siger Cavenee.
Så snart Croce havde mistanke om en forbindelse mellem microRNA'er og kræft, begyndte han at stille spørgsmål: Ville kræftceller have forskellige mængder af microRNA'er end normale celler har? Ville nogle mikroRNA'er være mere almindelige end andre i visse typer kræft? ”Han var virkelig den første person, der gjorde dette spring, ” siger Slack om Croces tidlige indsats på microRNA'er. "Det tog nogen med Carlos 'vision og penge for virkelig at bevæge marken fremad."
I 2003 rekrutterede Croce Chang-Gong Liu, dengang en mikrochipudvikler hos Motorola, til at designe et værktøj, der kan teste for tilstedeværelsen af mikroRNA'er i en prøve af celler eller væv. Ved hjælp af værktøjet, kaldet en mikroarray, har Croces laboratorium fundet microRNA'er, der synes at være unikke for visse typer kræftformer. For de 3 til 5 procent af patienterne, hvis kræft har metastaseret eller spredt fra en ukendt kilde i kroppen, er konsekvenserne af dette fund enormt. Fordi at vide, hvor kræft begyndte, er en nøgle til optimal behandling - tumorer, der opstår i forskellige væv reagerer på forskellige tilgange - kan microRNA muligvis hjælpe onkologer med at ordinere de bedste behandlinger for sådanne patienter.
MicroRNAs kan også være i stand til at estimere en kræfts sværhedsgrad. Croce og hans samarbejdspartnere fandt, at niveauerne af to mikroRNA'er - kaldet Let-7 og mir-155 - forudsagde overlevelse hos lungekræftpatienter. Croces gruppe har også fundet mikroRNA'er, der forudsiger, om en patients CLL vil blive aggressiv eller forblive mild. I fremtiden kan en patients mikroRNA-profil muligvis indikere, om han eller hun skal gennemgå en aggressiv og risikabel behandling eller en mildere, sikrere.
I dag har forskere identificeret omkring 40 mikroRNA-gener, der er forbundet med kræftformer, herunder bryst, lunge, bugspytkirtel og tyktarm. Ligesom konventionelle gener, der producerer proteiner, kan mikroRNA-gener også være kræftpromotorer, hvilket forårsager sygdommen, hvis de producerer for mange mikroRNA'er. Eller de kan være kræftundertrykkere; hvis de er beskadiget eller mistet, følger kræft. Desuden er forskere begyndt at forstå, hvordan mikroRNA interagerer med traditionelle kræftgener, og afslører et komplekst omskiftningsforbindelse, der ser ud til at ske inden i celler, når sygdommen overtager.
Croces største håb er, at microRNA'er en dag kan bruges som terapier. "Jeg er overbevist, helt overbevist, " siger han, "at mikroRNA'er bliver medicin." I nogle nylige eksperimenter har han og en kollega injiceret microRNA'er i mus med leukæmi eller lungekræft. Injektionerne, siger han, stoppede kræftvæksten.
"Beviserne er ekstremt stærke lige nu", at mikroRNA'er spiller en grundlæggende rolle i kræft, "siger Slack, " og det bliver stærkere og stærkere hver dag. "
Kræft er ikke den eneste sygdom, hvor mikroRNA fremgår som vigtige spillere. Undersøgelser antyder nu, at disse miniatyrgener er involveret i immunsystemfunktion, hjertesygdomme, schizofreni, Alzheimers sygdom og Tourettes syndrom. Derudover er der en lang liste over sygdomme, der ser ud til at have et genetisk grundlag, men som der ikke er identificeret noget konventionelt gen til. Thomas Gingeras, genomforsker ved Cold Spring Harbor Laboratory i New York, mener, at nogle af disse sygdomme i sidste ende vil være knyttet til mikroRNA'er. "Jeg tror, det vil uden tvivl være tilfældet, " siger han.
Måske er det fordi de små molekyler udøver så stor indflydelse på resten af kroppen. Forskere estimerer, at mennesker har omkring 1.000 mikroRNA-gener, som ser ud til at kontrollere aktiviteten i mindst en fjerdedel af vores 25.000 proteinkodende gener. "Vi er forbløffet over dette antal og mener, at det er et minimum, " siger Nobelprisvinderen Phillip Sharp fra MIT, i hvis laboratoriemikroRNA studeres.
Ikke underligt, at nogle forskere udtrykker forlegenhed og beklagelse af, at de ikke lykkedes at finde microRNA-gener før - hovedsageligt fordi de ikke udfordrede grundlæggende antagelser om gener.
"Det var ikke et teknologisk problem, " siger Joshua Mendell, en microRNA-forsker hos Johns Hopkins. "Den teknologi, der kræves for at studere mikroRNA, er ikke forskellig fra den teknologi, der blev brugt i de sidste par årtier, " siger han. "Det var mere en intellektuel barriere."
Selv Croce, for al sin succes, beklager, at han ikke genkendte microRNA'er tidligere. I slutningen af 1980'erne forfulgte hans team et kræftgen i en DNA-strækning, der ikke kode for proteiner. "Så vi trashede projektet, " siger Croce. Nu ved han, at genet var et mikroRNA. "Bias, " siger han, "er en dårlig, dårlig ting."
Sylvia Pagán Westphal er en forfatter, der bor i Boston, der har specialiseret sig i at dække genetik, biologi og medicin.








 "Vi ændrer dogmen" om, hvad forskere mener om menneskeligt DNA, siger forsker George Calin (på hans University of Texas Lab). Men hans banebrydende arbejde med Croce begyndte dårligt. Der var "intet værre, " spøger han. (Robert Seale)
"Vi ændrer dogmen" om, hvad forskere mener om menneskeligt DNA, siger forsker George Calin (på hans University of Texas Lab). Men hans banebrydende arbejde med Croce begyndte dårligt. Der var "intet værre, " spøger han. (Robert Seale)  Konventionel visdom hævdede, at kun en enorm strækning af DNA kunne fungere som et gen. Opdagelsen af en overset genetisk enhed forhindrer denne opfattelse. Croce "var bedøvet." (Greg Ruffing / Redux)
Konventionel visdom hævdede, at kun en enorm strækning af DNA kunne fungere som et gen. Opdagelsen af en overset genetisk enhed forhindrer denne opfattelse. Croce "var bedøvet." (Greg Ruffing / Redux)  Molekylærbiolog Gary Ruvkun. (Jared Leeds)
Molekylærbiolog Gary Ruvkun. (Jared Leeds)  Udviklingsbiolog Victor Ambros. (Jared Leeds)
Udviklingsbiolog Victor Ambros. (Jared Leeds)  Mens de studerede mutanter af en mikroskopisk orm, identificerede Gary Ruvkun og Victor Ambros et gen, der var umuligt lille. "Vi var glade for at have fundet noget nyt, " siger Ambros, "og så blev vi forundrede." (Photo Researchers, Inc.)
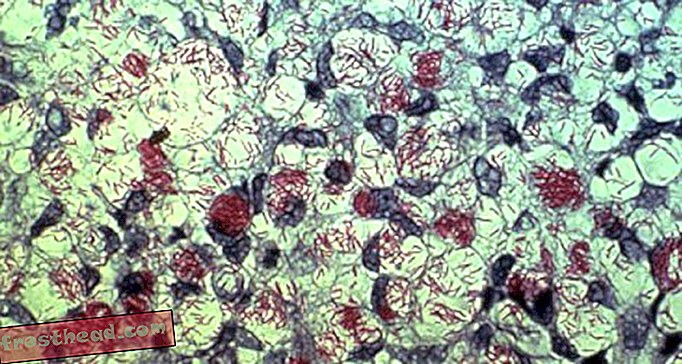
Mens de studerede mutanter af en mikroskopisk orm, identificerede Gary Ruvkun og Victor Ambros et gen, der var umuligt lille. "Vi var glade for at have fundet noget nyt, " siger Ambros, "og så blev vi forundrede." (Photo Researchers, Inc.)  Takket være nylige undersøgelser er det klart, at mikroRNA hjælper med at gøre nogle celler ondartede (leukæmiceller i lyserøde midt i sunde røde blodlegemer). Nu håber forskere at bruge det genetiske materiale til at forbedre kræftdiagnose og -behandling. (© 2009 rektor og besøgende på University of Virginia)
Takket være nylige undersøgelser er det klart, at mikroRNA hjælper med at gøre nogle celler ondartede (leukæmiceller i lyserøde midt i sunde røde blodlegemer). Nu håber forskere at bruge det genetiske materiale til at forbedre kræftdiagnose og -behandling. (© 2009 rektor og besøgende på University of Virginia)  Croce (derhjemme i Ohio) kan lide at købe lærreder, før han ved, hvem der malede dem. "Hans kunstsamling har den samme eksperimentelle bøjning, som hans videnskab har, " siger en kollega. (Greg Ruffing / Redux)
Croce (derhjemme i Ohio) kan lide at købe lærreder, før han ved, hvem der malede dem. "Hans kunstsamling har den samme eksperimentelle bøjning, som hans videnskab har, " siger en kollega. (Greg Ruffing / Redux)  MicroRNA på arbejdspladsen : Et typisk gen er en lang DNA-strækning med kemiske baser som trinene i dobbelt helix; et gen koder for et messenger RNS, der leder bygningen af et udpeget protein. Et mikroRNA-gen koder for et stort RNA, der kan holde sig til en del af et messenger-RNA, og slukke for proteinsamling. (5W Infographics)
MicroRNA på arbejdspladsen : Et typisk gen er en lang DNA-strækning med kemiske baser som trinene i dobbelt helix; et gen koder for et messenger RNS, der leder bygningen af et udpeget protein. Et mikroRNA-gen koder for et stort RNA, der kan holde sig til en del af et messenger-RNA, og slukke for proteinsamling. (5W Infographics)