Der er et fotografi af LaDonna Lopossa, der hjælper med at fortælle historien. Hun er alle smilende, liggende på græsset på en vagt Betty Grable-måde oven på sin egen kirkegårdgrund. Portrættet var hendes mands idé - i deres årtier sammen ser det ud til, at George, alias Mr. No Serious, aldrig så en gag, han ikke kunne lide - men det var LaDonna, der kom med ostekageposen.
Relateret indhold
- Høj håb for en ny slags gen
- De 'hemmelige jøder' i San Luis Valley
"OK, " havde George sagt, "tag nu din skjorte af."
”George!”
Klik.
På den ene side er det et fjollet øjebliksbillede af en 60-årig kvinde i en cardigan og fornuftige sandaler i Winlock, Washington, en solskinsdag i maj 2000. På den anden side er det et glimt af en mulig fremtid, hvor videnskaben har løst et skræmmende problem. For det er sådan, LaDonna og George stod overfor hendes dødbringende kræft, ikke bare hvislede forbi kirkegården, men kløfter rundt midt i den.
Tre måneder før lå LaDonna i en hospitalsseng i Olympia ved at tegne gardinet. Der var meget at give slip på: fire voksne børn, flere barnebørn, venner i kirken, et godt ægteskab. (Husk ikke, at da hun lå der, sagde George højlydt sygeplejerskerne, at han skulle slå stængerne for at finde en anden kone, som hun forstod som hans ulige kæmpeindsats for at lette hendes sind.) Hun var klar til at forlade alle disse ting og mere på grund af smerten.
Hendes milt, normalt gemt under det nederste venstre ribben og ikke større end en fersken, var så oversvømmet med hvide blodlegemer, at det var på størrelse med en cantaloupe. Hun kunne næppe gå. Hendes hud var spøgelsesagtig, hendes blod farligt kort fra røde celler. At trække vejret var en opgave. Regelmæssig opkast. At stikke smerter dybt inde i hendes knogler, hvor margen hidtil udbrød hvide celler eller leukocytter. Tilbagevendende feber. Og koldt, underligt, unødigt koldt : hun fryser under hospitalets tæpper.
Hun var for gammel og for syg til at gennemgå en knoglemarvstransplantation, en uhyggelig, meget risikabel behandling for hendes blodkræft, kronisk myeloid leukæmi (CML). Hun havde allerede prøvet den anden standard CML-behandling, regelmæssige doser af det kraftige sammensatte interferon. Men det så intensiverede hendes kvalme, feber og knoglesmerter, at hun opgav medicinen, hvad der måtte være. Da der ikke var noget tilbage i deres leukæmi-bekæmpende arsenal, var lægerne nede på Dilaudid, et derivat af morfin, det narkotiske smertestillende middel. Det var beroligende, det var trøstende, og for en patient i hendes tilstand var det selvfølgelig slutningen.
George havde givet de fleste af sine ejendele væk og havde reserveret en U-Haul-lastbil til at vogne sine ting til det sydlige Californien, hvor han ville flytte ind hos en af deres sønner. Musikken til hendes begravelse blev valgt, herunder ”Fordi jeg har fået meget”, som skulle synges af barnebørnene. Da hospitalet anbefalede at flytte LaDonna til en hospice, tog George hende i stedet hjem og fulgte hendes læge råd om at indkalde børnene; Terry, Darren og Stephen fløj op fra Los Angeles-området, og Kelly kørte over fra hendes sted i Winlock. En efter en gik de ind i soveværelset, sad ved LaDonnas seng og sagde farvel.
CML er en af de fire hovedtyper af voksen leukæmi, men det er ikke almindeligt, og rammer 5.000 mennesker i USA hvert år. Som regel er det dødbringende, hvor de fleste patienter dør inden for fem år efter diagnosen. Den første fase, en stealthy eksplosion af ellers normale hvide blodlegemer, kan vare måneder eller år; patienter advares ofte om tilstanden ved en rutinemæssig blodprøve. Hvis sygdommen ikke kontrolleres, bliver de hvide celler mere og mere unormale og udsteder helter-skelter fra bestemte stamceller i knoglemarv kaldet myeloide celler; sådanne leukocytter sprænger kapillærer, overvælder organer og kvæver væv ved at trænge ud iltbærende røde blodlegemer. Sygdommens forløb er usædvanligt forudsigelig, siger læger, men dens urværkskarakter har også givet forskere en mulighed: Prying i de molekylære gear og fjedre, der driver CML, de forstår det bedre end nogen anden kræft.
En gang, i begyndelsen af december 1999, kørte George for at se LaDonna på hospitalet i Olympia og stoppede ved en Safeway for at købe en avis. Mr. No Serious er en ivrig læser, havde endda kort drevet en boghandel med LaDonna, og han fortærede papiret i sit hospitalrum. Da det skete, blev en eksperimentel leukæmi-behandling derefter overskrifter. "Leukæmi-pille holder løfte, " rapporterede Associated Press og sagde, at CML-patienter "havde normale blodtællinger inden for en måned efter begyndelsen af behandlingen." Undersøgelsen var derefter i gang på Oregon Health & Science University (OHSU) i Portland.
George skyndte sig ud af hospitalets rum for at finde LaDonnas onkolog.
Mål for intervention
En stejl, snoet, træbelagt vej fører til hovedcampus, som ligger ved toppen af toppen af den 574 fod høje Marquam Hill og på tåge dage ser ud til at flyde over byen som et slot i et eventyr. En anden rute op til OHSU er Portland antennetram: to schweiziskfremstillede gondolbiler af skinnende stål svæver på kabler højt over Interstate 5, der suser folk frem og tilbage mellem den vestlige bred af Willamette-floden og en hospitalplatform, der ligger tættere på kanten af en klippe end at gå ud af hjertepatienter måske ønsker det.
Brian Druker ankom til OHSU i 1993, år inden trikken skulle bygges, og hall-of-fame-vægmaleriet i den tilstødende gang ville indeholde et billede af ham. Høj, så slank og letfodet som en gråhund, blødpratende, Druker var 38 år og havde lige tilbragt ni år på Dana-Farber Cancer Institute, en del af Harvard Medical School, i Boston. ”Jeg så kræft som et problem, ” huskede han på den undersøgelsessti, han valgte efter at have afsluttet medicinsk skole på University of California, San Diego. ”Folk begyndte at få nogle tip og nogle spor, og det virkede bare for mig, at det i min levetid sandsynligvis ville give efter for videnskab og opdagelse.”
I Dana-Farber landede Druker i et laboratorium, der studerede, hvordan en normal menneskelig celle giver anledning til løbsk vækst - malignitet. Laboratoriet har blandt andet fokuseret på enzymer, proteiner, der ændrer andre molekyler ved at nedbryde dem (tarmenzymer, for eksempel hjælper med at fordøje mad) eller binde dem sammen (hårsækkende enzymer konstruerer silkeagtige keratinfibre). Enzymer figurerer også i kædereaktioner, hvor det ene enzym aktiverer et andet og så videre, indtil der er opnået noget komplekst cellulært resultat; således kan en celle styre en proces såsom vækst eller opdeling ved at indlede en enkelt reaktion, ligesom at tippe den første domino. Under laboratoriesjefen, Thomas Roberts, behersker Druker adskillige teknikker til sporing og måling af enzymer i vævsprøver og til sidst vendte sig om til en, der er impliceret i CML.
Arbejdet med detaljerne om, hvorfor netop dette enzym er nøglen til CML, havde involveret hundreder af videnskabsfolk over hele verden - forskning, der ville føre til flere Nobelpriser - men her er dybest set, hvor Druker startede:
For det første har alle CML-patienter det renegade-enzym i deres hvide blodlegemer.
For det andet er selve enzymet et produkt af et freakish gen, kaldet BCR-ABL, dannet under en enkelt myeloid stamcelleopdeling og derefter overført til milliarder af efterkommere: spidserne af to kromosomer, de spindelige strukturer, der opbevarer DNA, bytter faktisk steder, hvilket får adskilte gener kaldet BCR og ABL til at smelte sammen (se illustration). Det nye mutant BCR-ABL-gen ligger på et særegent kromosom opdaget i 1960 af forskere ved University of Pennsylvania. Dette "Philadelphia-kromosom", der er synligt gennem et mikroskop, er CMLs kendetegn.
For det tredje er BCR-ABL-enzymet den onde tvilling af et normalt enzym, der hjælper med at kontrollere produktionen af hvide blodlegemer. Men som en switch, der sidder fast i “on” -position, ansporer mutanten den vilde spredning, der er leukæmi.
Du behøvede ikke at være Harvard-læge for at se, at et enkelt enzym, der forårsager en dødelig leukæmi var, som forskerne siger, et attraktivt mål for intervention. Og faktisk begyndte videnskabsmænd derefter at finde eller opfinde forbindelser, der kunne blokere BCR-ABL-enzymet.
Druker og hans medarbejdere i Boston, ved hjælp af specielt designet antistoffer, udviklede en ny måde at måle enzymets aktivitet på - et værktøj, der ville være uvurderligt til evaluering af potentielle CML-behandlinger. Druker, der var en slips-bærende læge blandt jeanklædte ph.d.er, kæmpede for konkurrenter på andre forskningscentre for at finde et lægemiddel, der undertrykker kræft ved at deaktivere et kritisk enzym og skåner sunde væv i købet. Traditionelt bombarderede kræftbehandlinger kroppen med magtfulde medikamenter og dræber både sunde og kræftceller - ”cytotoksisk kemoterapi, ” kalder læger det. Den alternative målrettede terapi ville bekæmpe kræft bedre med mindre sikkerhedsskade, eller i det mindste var det den opfattelse, der ofte holdt Druker i laboratoriet indtil kl. 23
Så begyndte tingene at falde fra hinanden. ”Mit ægteskab var gået i stykker. Jeg var ikke det, du ville kalde en hengiven mand. Jeg var en hengiven forsker og videnskabsmand og læge. Og det tog en vejafgift. ”(Druker og hans kone splittede sig efter to års ægteskab og blev senere skilt.)
Alligevel, med en score på offentliggjorte undersøgelser og en fin enzymmålingsteknik til at vise for sin indsats, troede Druker, at han var klar til at flytte op på Harvard-stigen fra instruktør til lektor. ”Jeg satte mig ned med lederen af medicinsk onkologi i Dana-Farber, ” huskede Druker. ”Han kiggede over mit cv og sagde: 'Jeg tror bare ikke, at dette arbejde vil gå overalt her.“ ”Oversættelse:“ Jeg fik at vide, at jeg ikke havde nogen fremtid i Dana-Farber. ”
”Det var forfærdeligt, ” huskede han. ”Jeg var deprimeret. Men det tvang mig til virkelig at sige: Tror jeg på mig selv? Skal jeg gøre det, gøre en forskel? ”
Voksende bekymring
En forsker blev bedt om at beskrive Drukers tilgang, sagde, at den kogte ned til "udholdenhed og stædighed ved ikke at give slip på en idé."
”Jeg tror i bund og grund, at han er en genert person, ” sagde en anden. ”Men på dette” - kræftterapi - ”han er som en korsfarer.”
”Han tager alt, hvad der er kompliceret, skyver det i tankerne og udsender den mest enkle tolkning og indgriben.”
”Når du stiller et spørgsmål, er der tavshed i rummet, næsten ubehagelig stilhed, og du er ligesom, har han endda hørt mig? Han tænker ting igennem, før han giver et svar. ”
"Han lader videnskaben tale."
Druker voksede op som den yngste af fire børn i St. Paul, Minnesota, og gik på offentlige skoler og udmærkede sig i matematik og videnskab. Hans far var kemiker på 3M, hvis arbejde med udskrivningsprocesser blev patenteret. Hans mor var en hjemmeværende, der blev involveret i skolebestyrelsespolitik og løb uden succes for statslovgiveren. Efter uddannelsen med en kemiuddannelse fra UC San Diego blev han ved, og i 1978, hans første år i medicinsk skole, skrev han et papir på 16 sider, der antydede en fremtid, han ville hjælpe med at skabe. Det blev skrevet i langhånd med blåt blæk på foret notatpapir og med titlen "Cancer-kemoterapi", og konkluderede det, at når kræftlægemiddels virkning "forstås i biokemiske termer, bør kræftkemoterapi gøre fremskridt langt ud over de allerede gjort fremskridt. ”
Efter at Dana-Farber Cancer Institute gav ham slynget, stormede Druker nye beslutninger. ”Da jeg flyttede hit til Oregon, var mit mål at identificere et lægemiddelfirma, der havde et lægemiddel til CML og få det ind i klinikken, ” sagde han.
Han havde tidligere mødt Nick Lydon, en biokemiker hos det schweiziske farmaceutiske firma Ciba-Geigy (som ville fusionere med Sandoz i 1996 for at danne Novartis). Lydon havde samarbejdet med Roberts, Drukers tidligere labchef. ”Jeg ringede til min ven Nick på Ciba-Geigy, og han sagde: 'Vi har det, du leder efter.'” Det blev kaldt STI571. Virksomhedskemikere havde syntetiseret det og andre forbindelser, mens de søgte efter et nyt antiinflammatorisk lægemiddel, men de havde lært, at det også kunne blokere aktiviteten af enzymer i et reagensglas. De havde stadig ikke helt bestemt sig for, hvad de skulle gøre med forbindelsen.
I august 1993 modtog Druker sin første portion væske STI571 og en anden kandidatforbindelse fra Schweiz. Ved hjælp af det enzymmålingsværktøj, som han havde hjulpet med at udvikle, bekræftede han, at STI571 stærkt hæmmede BCR-ABL-enzymet, som hører til en klasse af enzymer kendt som tyrosinkinaser; den anden forbindelse gjorde det kun svagt. Han hældte også små mængder STI571 i en bakke med fingerbold-containere, der holdt væske og levende hvide blodlegemer afledt af en CML-patient. Druker havde håbet, at cellernes vækst ville forsinke eller stoppe. Endnu bedre døde cellerne. Desuden gjorde en stor mængde STI571, der blev givet til raske celler i en skål, ingen skade. ”Brian's bidrag var kritisk, ” mindede Lydon om at overbevise virksomheden om at ”bevæge sig i den retning.”
Men naturligvis er vejen til stiplede forhåbninger brolagt med eksperimentelle medikamenter, der så fantastisk ud i et reagensglas, men mislykkedes hos mennesker. Skeptikere påpegede, at hundreder af forskellige typer tyrosinkinase-enzymer er i arbejde i kroppen, og, tilføjede de, ville et lægemiddel, der blokerede en også blokere mange andre og udløse fysiologisk ødelæggelse? ”Der var mange naysayers, der argumenterede for, at det ville være umuligt at udvikle specifikke proteinkinaseinhibitorer” til behandling af kræft, skrev Tony Hunter, en biokemiker ved Salk Institute i La Jolla, Californien, i Journal of Clinical Investigation .
Videnskabelige ideer slår ikke rod som mælkebøttefrø, der vattes på frugtbar jord. De har brug for fortalere, mennesker, der vil vinde . Druker blev tilsluttet og udført flere eksperimenter, såsom at inducere en form for CML i laboratoriemus og udsætte dem for STI571. Det hele undtagen fjernede dyrenes sygdom. ”Jeg satte sandsynligvis 60 til 80 timer om ugen, ” huskede Druker, der i sin knappe fritid konkurrerede i cykelløb, en sport, der kræver en høj tolerance for smerte og en fornemmelse af, hvornår man skulle bryde ud af pakken. ”Mit liv i de dage var, at jeg ville arbejde [i laboratoriet], træne, spise og sove.” Det, der sagde, var, at han var CML-patienter, der var ved at dø.
I 1997, efter at have offentliggjort adskillige undersøgelser med medarbejdere i Portland og Schweiz, mente Druker, at forbindelsen var klar til at blive prøvet hos mennesker. Novartis var uenig. For det første, når hunde havde fået lægemidlet i intravenøs form, havde det en tendens til at forårsage blodpropper i slutningen af kateteret. Novartis-kemikere brugte måneder på at reformulere det flydende stof som en pille. Men da forskerne gav store doser til hunde, viste dyrene tegn på leverskade. Nogle virksomhedsembedsmænd, huskede Druker, rådede til, at projektet helt droppede.
Men skaden på hjørnetænden flamede ham ikke; kemoterapi er trods alt destruktiv. ”Vi vidste, hvordan man kunne give folk giftige kræftformer, ” sagde han.
Den næste ting Druker gjorde måske ikke har været ulovlig, men det var bestemt ikke kosher. Han omgåede Novartis og gik direkte til Food and Drug Administration for at se, om han havde samlet nok data til at starte en menneskelig prøve. ”Jeg kaldte toksikolog hos FDA og sagde:" Her er problemet. " Og han sagde: 'Min godhed, du har masser af data, vi ville sandsynligvis acceptere denne ansøgning.' ”Druker fortalte derefter Novartis, hvad han havde gjort. ”Jeg fik mig i noget varmt vand, fordi jeg var gået bag deres ryg.”
Endelig, i juni 1998, med FDA-tilladelse til at fortsætte, administrerede Druker STI571 til et menneske, en 68 år gammel Oregon-mand med CML. "Det var næsten antiklimaktisk, " mindede Druker om, "ved at vi var klar i november 1996, og her var det over halvandet år senere."
Han havde rekrutteret to fremtrædende onkologer til at hjælpe med at køre det kliniske forsøg, Moshe Talpaz ved MD Anderson Cancer Center i Houston og Charles Sawyers ved UCLA. Alle CML-patienter, der var indskrevet i de tre byer, havde gennemgået interferonbehandling og havde enten ikke forbedret eller var tilbagefaldt. Ingen var berettiget til en knoglemarvstransplantation.
Efterhånden som man øgede STI571-doseringen, observerede lægerne omkring seks måneder, at astronomisk hvidt blodantal på næsten 100.000 celler pr. Kubik millimeter faldt til under 10.000, godt inden for det normale. Analyse af en af de første patienters hvide blodlegemer fandt ingen tegn på Philadelphia-kromosomet, hvilket antyder, at leukæmien var blevet stoppet ved kilden. Mere imponerende, uanset hvilket spor af BCR-ABL-genet, der var tilbage, var ophørt med at kopiere. ”Det var da vi vidste, at vi havde noget, som man aldrig havde set før i kræftbehandling, ” sagde Druker.
Efterhånden som ordet blev spredt på Internettet, ønskede andre CML-patienter. Druker pressede Novartis for at fremstille mere af lægemidlet. Men Novartis var ikke klar. Stoffet var vanskeligt at fremstille, Daniel Vasella, dengang Novartis-administrerende direktør og nu bestyrelsesformand, ville huske i sin bog om stoffet, Magic Cancer Bullet . ”Heller ikke [lægemidlet] var højt prioriteret i betragtning af det lille antal CML-patienter, ” tilføjede han. Desuden ville det kræve en betydelig investering at bevise, at det var både sikkert og effektivt. ”En alvorlig bivirkning kunne udvikles hos en ud af 1.000 patienter, og det ville være afslutningen på forsøget, ” skrev han.
I september 1999 fik Druker en e-mail fra en 33 år gammel CML-patient i Montreal, Suzan McNamara. Hun havde været på interferon, som havde undertrykt hendes sygdom i næsten et år, men nu brølede det tilbage, og hun ville deltage i en STI571-prøve. ”Jeg var syg til det punkt, hvor jeg næppe kunne forlade mit hus, ” huskede hun til mig.
Druker ringede til hende næste dag og sagde, at det ville gå måneder før hun kunne tilmelde sig et studie - Novartis havde ikke forpligtet sig til at producere mere STI571. Men, tilføjede han, at virksomheden måske flytter hurtigere, hvis det hørte direkte fra patienter.
McNamara og en ven brugte et internetside til at oprette en andragende, der anmodede om, at stoffet blev gjort mere udbredt; tusinder af CML-patienter godkendte det. Hun sendte det til Vasella med et brev, der sagde, "Vi har med voksende bekymring set vores overbevisning ... om, at forsyningen af stoffet ikke har været tilstrækkelig til at udvide forsøgene så hurtigt som beviset til dato ville berettige."
”Brevet kunne ikke ignoreres, ” har Vasella sagt. Virksomheden øgede STI571-produktionen.
Æren ved at meddele de tidlige kliniske resultater faldt til Druker. I New Orleans den 3. december 1999 fortalte han et auditorium fuldt af hæmatologer, at alle 31 patienter i undersøgelsen svarede positivt på STI571, hvor antallet af hvide blodlegemer på 30 faldt til det normale inden for en måned. Pillerens bivirkninger - forstyrrede maver, muskelkramper - var hvad onkologer kalder ”mild til moderat.” Druker siger, at han ikke kan huske den stående ovation.
Resultaterne var "en molekylær onkologs drøm, der blev til virkelighed, " skrev Harold Varmus, der nu leder National Cancer Institute og blev tildelt en Nobelpris for forskning, der lagde nogle af grundlæggene for STI571's succes. Stoffet, husker han i sin bog fra 2009, The Art and Politics of Science, var "det bedste bevis til dato, at de mest grundlæggende aspekter af kræftforskning havde dramatiske fordele for patienter med kræft."
CNN, New York Times, “Good Morning America” og Associated Press dækkede banebrydende kræftpiller.
Fremtidens bølge
Efter at LaDonna Lopossa og hendes børn sagde farvel i februar 2000, rejste hun ud et par dage mere og kom til en aftale i OHSU. LaDonnas onkolog og George havde formået at få hende ind i den anden fase af STI571-forsøget, som ville indskrive omkring 500 nye patienter på et dusin medicinske centre over hele verden. Hun blandede sig ind i klinikken på George's arm. ”Hvad har vi fået os ind i?” Sagde en af sygeplejerskerne, hvilket betyder, at LaDonnas død, som syntes nært forestående, ville regne som et sort mærke mod stoffet. Hendes hvide blodantal oversteg 200.000, mere end 20 gange normalt. ”Der var ingen to måder ved det, ” sagde Druker. ”Du kiggede på hende, og hun havde problemer.”
De undersøgte hende og gav hende en STI571-pille. Hun kastede det op.
Næste morgen vågnede George og LaDonna i hendes søsters lejlighed i Portland, og George lavede LaDonna til en banansk milkshake. Senere samme dag forblev STI571-pillen nede. Og det næste, og så videre.
”Inden for tre uger var hendes milt tilbage til praktisk taget normal, ” sagde Druker. ”Hun havde det godt. Hvid tælling var kommet ned. En Lazarus-lignende effekt. Det var virkelig mirakuløst. ”
Det var i maj samme år, at LaDonna og George besøgte kirkegården i Winlock for at placere blomster på hendes mors gravsted, som ligger ved siden af grunden, som LaDonna havde købt til sig selv. ”Jeg skulle være i den grav, ” sagde hun til George.
"Nå, " sagde han, "da du ikke er det, hvorfor tager vi ikke et billede?"
I slutningen af vinteren 2001 havde Druker og hans samarbejdspartnere samlet mange af deres STI571-data: hos omtrent 95 procent af patienterne var hvide blodlegemer tilbage til det normale, og i 60 procent blev Philadelphia-kromosomet ikke opdaget. Virksomheden indsendte resultaterne med sin ansøgning om nye lægemidler til FDA, som det godkendte i løbet af to og en halv måned - indtil i dag den hurtigste bedømmelse af lægemidlet i agenturets historie.
For ti år siden denne måned meddelte den amerikanske regering, at lægemidlet, som Novartis navngav Gleevec på det nordamerikanske marked (Glivec i Europa), ville være tilgængeligt for CML-patienter. Det var et afgørende øjeblik. Det forrige århundrede med kræftbehandlinger - intermitterende vellykket, baseret på forsøg-og-fejl-test, næsten altid irriterende - ville være kendt af eksperter som ”før Gleevec.” Fra da af var ”efter Gleevec, ” æraen med målrettet terapi. På en pressekonference i Washington, DC den 10. maj, kaldte sekretæren for sundhed og menneskelige tjenester, Tommy Thompson, stoffet et "gennembrud" og "fremtidens bølge." Den daværende direktør for National Cancer Institute, Richard Klausner, beskrev det som "et billede af fremtiden for kræftbehandling."
I dag er Suzan McNamara enig i, at fremtiden er god. Da hun først rejste til Portland i 2000 for at deltage i Gleevec-studiet, huskede hun: ”Jeg gik der med halvdelen af mit hår og anorektisk og kunne ikke engang gå op ad trappen. Og jeg kom tilbage om halvanden måned 20 kg tungere og fuld af liv. ”Hendes næste skridt var at gå på McGill University, studere leukæmibehandlinger og få en ph.d. i eksperimentel medicin. Nu 44, hun bor i Montreal og arbejder i Ottawa for Health Canada, et føderalt agentur. Stadig på Gleevec løber hun flere miles et par gange om ugen. ”Jeg ville gå mere, hvis jeg ikke var så doven, ” sagde hun. I januar 2010 giftede hun sig med sin mangeårige kæreste, Derek Tahamont, på Hawaii. ”Han stod ved mig gennem hele sygdommen og alt sammen, ” sagde hun. ”Vi besluttede at hoppe på et fly og gifte os på en strand, bare os to. Det var perfekt. ”
Gleevec har opfordret folk til at tro, at kræft ikke altid er en dødbringende invaderer, der skal udslettes, men en kronisk lidelse, der kan håndteres, som diabetes. I opfølgningsundersøgelser ledet af Druker havde ca. 90 procent af de nyligt diagnosticerede CML-patienter, der begyndte at tage Gleevec, overlevet fem år. ”Jeg fortæller patienterne, hvor optimistisk jeg er om deres fremtid, ” sagde Druker. ”Vi forventer for Gleevec, at den gennemsnitlige overlevelse vil være 30 år. En person, der får diagnosen 60 år, kan leve til 90 år og dø af noget andet. ”
Da LaDonna Lopossa var 60, huskede hun, sagde Druker, at han ville holde hende i live, indtil hun var 70. Så nåede hun den milepæl. ”Jeg mente, da jeg blev 70, ” spøgte han med hende dengang.
LaDonna, nu 71, og George, 68, bor i Battle Ground, Washington, en landlig by 24 km nord for OHSU, hvor LaDonna forbliver under Druker's pleje. Lopossas bor i en bungalow i et statssubsidieret ældreboliger på tværs af gaden fra en familie, der holder høns i gården og lader George dyrke urter. En indrammet magasinannonce til Gleevec med LaDonna hænger på en stuevæg. To portrætter af Kristus nåder en spisestuevæg. George, der er hurtig til at sige, at han ikke er religiøs - ”ingen ved, hvordan Jesus så ud, ” han sprang af LaDonnas ikonografi - har sin egen hule, hvor han ser ”Family Guy.”
LaDonna frivilligt ved North County Community Food Bank nede på gaden, i Mormon-kirken, hun hører til, og telefonisk rådgiver hun folk, der nyligt er diagnosticeret med CML, til Leukemia and Lymphoma Society. En af hendes største udfordringer i disse dage, sagde hun, er at overbevise patienter om at fortsætte med at tage Gleevec; de har ikke udholdt symptomerne på fulminerende CML, og nogle synes, at lægemidlets bivirkninger er irriterende.
Gleevec holdt LaDonnas CML i skak i syv år, på hvilket tidspunkt hendes sygdom blev resistent over for stoffet. Heldigvis havde medicinske videnskabsmænd og medicinalfirmaer udviklet to nye CML-medikamenter, som hver deaktiverer BCR-ABL-enzymet på en anden måde og kompenserede for en type Gleevec-resistens. Sprycel hjalp ikke LaDonna, men Tasigna gjorde det - i cirka to år. Nu er hun på sit fjerde målrettede CML-medikament, bosutinib, som stadig er eksperimentelt. ”Hendes leukæmi er den bedst kontrollerede, det nogensinde har været, siden jeg har taget sig af hende i de sidste 11 år, ” sagde Druker.
Personaliseret onkologi
Siddende ved det lille runde konferencebord i sit lille hjørnekontor højt på Marquam Hill, sagde Druker, at han stadig studerede CML, i håb om at forstå, hvordan man eliminerer enhver sidste mutante stamcelle, og han forsøgte også at anvende “Gleevec-paradigmet” til andre leukæmier. En lys gul cykel-racertrøje bæret og autograferet af Tour de France-mester og kræftoverlevende Lance Armstrong hang indrammet på væggen. Det var en klar dag, og den store vaniljeis-scoop af Mount St. Helens var synlig ud af vinduet mod nord, og den historiske hvide trekant fra Mount Hood kunne ses gennem vinduet mod øst. Fyren, der ikke havde de rigtige ting til at være adjunkt i Harvard, er i dag direktøren for OHSU's Knight Cancer Institute, opkaldt efter Phil Knight, grundlæggeren af Nike og en Portland indfødt, og hans kone, Penny, som i 2008 lovede $ 100 millioner til anlægget. ”Brian Druker er intet mindre end et geni og en visionær, ” sagde Phil Knight på det tidspunkt.
Hæderne er strømmet ind, inklusive feltets bedste amerikanske pris, Lasker-DeBakey Clinical Medical Research Award, som Druker delte i 2009 med Lydon og Sawyers. Af hans mange optrædener i nyhedsmedierne ville ingen ændre hans liv mere end en historie om ham i People, "The Miracle Worker", der blev udgivet i februar 2001. Magasinet havde sendt en reporter ved navn Alexandra Hardy til at interviewe den drage-dræbende læge på hospitalet i skyerne. De to blev gift i 2002 og er forældre til Holden, Julia og Claire. Sagde Druker: ”Jeg har nu evnen til at fokusere på familie som en prioritet. Det kunne jeg ikke have gjort for 10 eller 15 år siden. ”
For nogle observatører mistede Gleevec-fablen snart sin glans. "'Wonder Drug' for Leukemia Suffers Backback, " rapporterede Wall Street Journal i 2002, når nogle patienter blev resistente over for stoffet eller ikke kunne tolerere det. Det så ud til, at forskere var langsomme med at producere andre lægemidler, der var målrettet til at temme andre kræftformer, og der stilles spørgsmålstegn ved strategiens løfte. En Time- reporter bloggede i 2006, at Gleevec var et "Askepottestof" - et glassked, der passer til en enkelt kandidat. Sawyers sagde, at han blev træt af, at forskere sagde, at Gleevec var en engangs, et heldigt skud.
Lægemidlets omkostninger har været kontroversielle siden dag 1. Et års forsyning i USA kører nu omkring $ 50.000, eller omkring $ 140 per daglig pille. Det er det dobbelte af de oprindelige omkostninger, som Vasella havde forsvaret som "høj", men også "fair", fordi lægemidlet giver patienterne en god livskvalitet, og virksomhedens indtægter garanterer forskning i andre lægemidler. (Spurgt om årsagerne til prisstigningen afslog en talsmand fra Novartis at kommentere.) Under alle omstændigheder er et lægemiddel, som Novartis gik ud for at udvikle, fordi markedet var for lille, nu en blockbuster. I 2010 genererede Gleevec 4, 3 mia. Dollars i verdensomspændende salg - selskabets næsthøjeste medikament. For at være sikker har Novartis leveret gratis eller nedsat medicin til patienter med lav indkomst. I 2010 hjalp virksomheden omkring 5.000 amerikanske patienter ved at donere dem Gleevec og Tasigna, der også var et Novartis-lægemiddel, til 130 millioner dollars.
Men patienter, læger og andre har længe klaget over Gleevecs pris. I sin bog fra 2004, The Truth About the Drug Companies, antydede Marcia Angell, tidligere redaktør for New England Journal of Medicine, at Novartis var "hulning" af patienter på Gleevec. For nylig har læger rapporteret, at patienter stoppede med at tage Gleevec, fordi de ikke havde råd til det på trods af virksomhedens hjælpeprogram.
Druker, der sagde, at hans laboratorium har modtaget Novartis-forskningsfinansiering, men hverken han eller OHSU har nogensinde opnået Gleevec-royalties, beklager omkostningerne. ”Det skulle være en overkommelig pris, som ville være mellem $ 6.000 og $ 8.000 om året, ” fortalte han mig. ”Virksomheden ville stadig have masser af overskud.” Han fortsatte med, ”Mange kræftmedicin er nu prissat godt ud fra overkommelighedens område. Som en sundhedsindustri er vi nødt til at tackle det og tackle det. ”
Der vil være masser at beskæftige sig med: det ser ud til, at Gleevec ikke kun var et heldigt skud. Bare det faktum, at forskere hurtigt designede nye lægemidler til at klare Gleevec-resistens, viser, at de i stigende grad ved, hvad de laver, sagde Sawyers, nu på Memorial Sloan-Kettering Cancer Center. Han ledede en gruppe, der var den første, der forklarede modstand og var involveret i Sprycels udvikling. ”Hvorfor er jeg så optimistisk?” Sagde han. ”Vi kender fjenden, og vi ved, hvordan vi skal besejre den.”
Faktisk vandt adskillige enzymmålrettede kræftbehandlinger FDA-godkendelse i Gleevec's kølvandet, herunder lægemidler mod bestemte former for lungekræft og bugspytkirtelkræft. Og forskere siger, at de lytter godt af behandlinger i kliniske forsøg. Nogle melanomepatienter, hvis sygdom er forårsaget af en kendt genetisk mutation ser ud til at drage fordel af et eksperimentelt lægemiddel kaldet PLX4032. Sawyers studerer en form for prostatacancer, der er ansporet af en mutant hormonreceptor, og han sagde, at kliniske test af et lægemiddel (kaldet MDV3100) målrettet mod det er ”spændende.” En medicinalindustrianalyse anslår, at medicinalfirmaer i øjeblikket udvikler og tester næsten 300 målrettede molekylære kræftbehandlinger à la Gleevec.
Arul Chinnaiyan, en forskningspatolog med speciale i kræft ved University of Michigan Medical School, i Ann Arbor, er ærlig over Gleevecs indflydelse. ”Vi prøver at franchise dens succes, ” sagde han om sine forsøg på at anvende målrettet terapimetoden til solide tumorer, som er mere komplekse end CML. Hver type fast tumor kan være drevet af flere ukorrekte enzymer og receptorer - proteinstrukturer, der transmitterer kemiske meddelelser - og forskellige mutationer kan variere fra person til person. Chinnaiyan himself has discovered two different mutant gene fusions analogous to BCR-ABL that appear to drive many prostate cancers. “The thought is if we know these are the molecular lesions, we'll be able to match the drug or combination of drugs appropriately, ” Chinnaiyan said.
Jeg fik en fornemmelse af, hvad han kalder ”personlig onkologi” en dag på en bryggeripub i Ann Arbor. På tværs af det arrede træbord, der spiste en bacon cheeseburger og nipper til øl, var Jerry Mayfield, 62, en tidligere Louisiana-statstroper. Diagnosticeret med CML i 1999, blev Mayfield på det tidspunkt fortalt af sin hæmatolog, at han havde to til tre år at leve. Mayfield spurgte, om der var eksperimentelle medikamenter at overveje. Lægen sagde nej. Mayfield tjekede Internettet, lærte om STI571 og, efter at have undervist sig i programmering af computeren, mens han bemandede natbordet på politiets hovedkvarter i Monroe, oprettede et websted, newcmldrug.com, for at informere andre patienter. Hvis han havde lyttet til sin hjemby, sagde Mayfield, "uden tvivl ville jeg ikke være her i dag."
Han driver stadig sit websted, og bor i disse dage i Bloomington, Illinois. Han var i Ann Arbor for at se Talpaz, der havde samarbejdet om de indledende kliniske forsøg med Gleevec i Houston, men var flyttet til University of Michigan. Han har taget sig af Mayfield i mere end et årti og administreret målrettede behandlinger i rækkefølge, efterhånden som Mayfield blev resistent eller ikke længere kunne tolerere dem: Gleevec, Sprycel, Tasigna, bosutinib og nu ponatinib, endnu et eksperimentelt kinase-blokerende CML-lægemiddelløb gennem klinisk forsøg.
Mayfield er "en plakatdreng til CML-terapi, " fortalte Talpaz mig. ”Han har det meget godt.”
Over pubens blaring musik sagde Mayfield om sit BCR-ABL-gen, "Jeg havde G250E-mutationen - har G250E-mutationen - det er derfor, jeg blev resistent over for Gleevec."
Hans bemærkning lød som noget ud af en tidsmaskine, der er programmeret til år eller årtier fra nu, hvor folk nonchalant vil tale om deres dødbringende genetiske mutationer og de medikamenter, der lider dem. Det er et billede, som Druker ofte fremtrykker. ”I en ikke alt for fjern fremtid, ” skrev han, når han accepterede Lasker-DeBakey-prisen, ”vil klinikere være i stand til grundigt at analysere individeres tumorer for molekylære defekter og matche hver person med specifikke, effektive behandlingsformer, der giver en varig respons med minimal toksicitet. ”
Mayfield er aldrig blevet behandlet af Druker men har konsulteret ham. ”Jeg sad på min lokale onkologkontor for en dag for ti år siden, og min mobiltelefon ringede, ” sagde Mayfield. ”Det var Dr. Druker. Jeg havde sendt ham en e-mail. Jeg var bedøvet. Jeg sagde til min onkolog, 'Det er uhøfligt at besvare dette opkald, men dette er min helt.' Han er en sådan venlig og blid og dedikeret mand, ikke mindst arrogant. Han har reddet så mange liv. Alle i landet burde kende sit navn. Han er den slags idol, vi skulle have, i stedet for sportsstjerner. ”
Mayfields websted har et "påskønnelsesalbum" dedikeret til Druker, fyldt med hyldest fra CML-patienter. Snapshot efter snapshot viser mennesker, der smiler i stærkt sollys - vandre, plante træer, drikke champagne - mennesker, der følte sig bevægede til at sige, at de skyldte ham, ja, alt . De indsendte dusinvis af digte og limericks, som denne af en patient ved navn Jane Graham:
Der var engang en læge ved navn Brian
På hvis forskning vi alle var afhængige af
Han vidste, at vi var syge,
Så han lavede os en pille,
Og nu planlægger vi ikke 'dyin.'
I modsætning til forventningerne
Druker mødtes med LaDonna Lopossa i undersøgelsesrummet, hvor han ser undersøgelsespatienter hver torsdag. George, der siger, at LaDonna har en "usænkelig-Molly Brown kvalitet", havde kørt hende ned fra Battle Ground for hendes kontrol. Hun sad i en stol, mens Druker, iført en løstsittende mørkeblå dragt, lænede sig mod kanten af et eksamensbord. ”Jeg ville ikke være her uden dig, ” sagde LaDonna (muligvis til min fordel).
”Nå, du er her, ” sagde Druker. "Du har det godt."
”Jeg kan godt lide at danse i gaderne godt.”
"Store. Nogen problemer?"
"Ingen. Jeg har bare et udslæt. ”
”Hvornår startede det?”
”For cirka ti uger siden.”
Han spurgte om udslæt, og senere forlod jeg lokalet, så han kunne undersøge hende.
”Arbejder du stadig i fødevarebanken?” Spurgte han.
”Jeg laver en dag om ugen.”
”Hvordan går det?”
”Terrific.”
”Hvordan har din energi?”
”Min energi er lav. Men min hjerne er aktiv. ”
"Du gør bare spektakulært, leukæmimæssigt."
"Jeg ved det. Jeg kan føle det."
"Hvad ellers? Spørgsmål til mig? ”
”Jeg tager en tur i morgen.”
"Til?"
”San Diego og Knott's Berry Farm med alle mine børnebørn.” Hun opdaterede deres fremskridt, og Druker sagde deres aldre, som for at kontrollere, at han havde fakta rigtigt. Når han henvender sig til forskere på faglige konferencer, viser han ofte fotografier af LaDonna og hendes børnebørn. I modsætning til alle forventninger, siger han, begynder hun at se sine oldebørn vokse op.
”Jeg har et så vidunderligt liv, ” sagde LaDonna og rev i stykker. ”Og jeg ville ikke have det. Jeg sagde til mine læger, 'Gør ikke mere mod mig.' ”
Da hun smuttede øjnene med et væv, nævnte hun sit første besøg på klinikken i 2000, da hun næppe havde gjort det gennem døren. ”Det var længe siden, ” sagde hun til nogen i særdeleshed.
Derefter sagde hun til Druker: "Men det er gået hurtigt, er det ikke?"
”Har det ikke?” Sagde han.
Terence Monmaney skrev først for Smithsonian i 1985. Han er udøvende redaktør. Den Portland-baserede Robbie McClaran fotograferede sin adopterede hjemby til november 2010-udgaven.








 LaDonna Lapossa slår en stilling oven på hendes kirkegårdgrund i 2000. (Courtesy Ladonna Lapossa)
LaDonna Lapossa slår en stilling oven på hendes kirkegårdgrund i 2000. (Courtesy Ladonna Lapossa)  "Vi ser lige begyndelsen på at matche patienter med det rigtige lægemiddel og se hurtige forbedringer, " siger Dr. Brian Druker. (Robbie McClaran)
"Vi ser lige begyndelsen på at matche patienter med det rigtige lægemiddel og se hurtige forbedringer, " siger Dr. Brian Druker. (Robbie McClaran)  Diagnosticeret med leukæmi i 1999 fik Jerry Mayfield, hjemme hos ham i Bloomington, Illinois, fortalt, at han havde to til tre år at leve. ”Jeg håbede på at se årtusindet, ” siger den tidligere statstrooper, der oprettede et websted om en ny terapi, han begyndte at tage. (Tim Klein)
Diagnosticeret med leukæmi i 1999 fik Jerry Mayfield, hjemme hos ham i Bloomington, Illinois, fortalt, at han havde to til tre år at leve. ”Jeg håbede på at se årtusindet, ” siger den tidligere statstrooper, der oprettede et websted om en ny terapi, han begyndte at tage. (Tim Klein)  Suzan McNamara, der var meget syg med leukæmi, begyndte at tage stoffet Gleevec i 2000. Ti år senere blev hun gift på Hawaii. (Høflighed Suzan McNamara)
Suzan McNamara, der var meget syg med leukæmi, begyndte at tage stoffet Gleevec i 2000. Ti år senere blev hun gift på Hawaii. (Høflighed Suzan McNamara)  "Dette er en meget spændende tid at være i kræftforskning, " siger Arul Chinnaiyan (her på sit laboratorium fra University of Michigan), der er inspireret af Gleevecs succes. "Jeg er meget optimistisk teknologi er til det punkt, hvor vi kan finde den genetiske oprindelse for forskellige kræftformer." (Fabrizio Costantini / Aurora Select)
"Dette er en meget spændende tid at være i kræftforskning, " siger Arul Chinnaiyan (her på sit laboratorium fra University of Michigan), der er inspireret af Gleevecs succes. "Jeg er meget optimistisk teknologi er til det punkt, hvor vi kan finde den genetiske oprindelse for forskellige kræftformer." (Fabrizio Costantini / Aurora Select)  "Når du næsten er død, får du et andet perspektiv på livet, " siger Lopossa, derhjemme med sin mand, George. "Du har større påskønnelse af det, vi har." (Robbie McClaran)
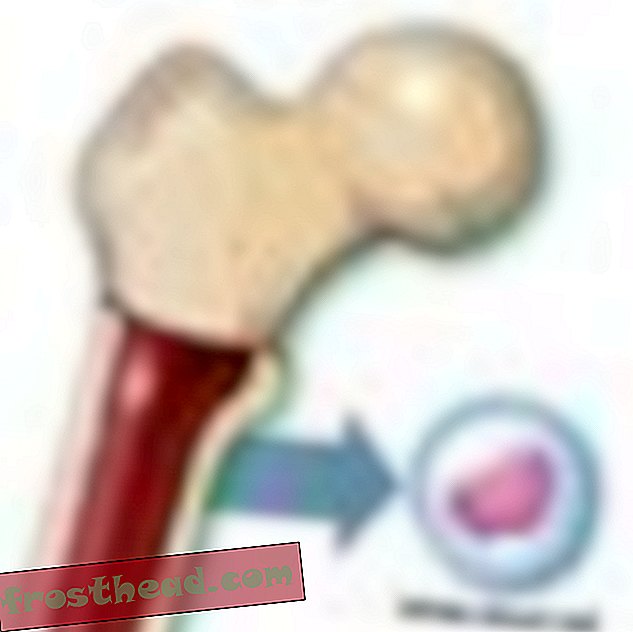
"Når du næsten er død, får du et andet perspektiv på livet, " siger Lopossa, derhjemme med sin mand, George. "Du har større påskønnelse af det, vi har." (Robbie McClaran) 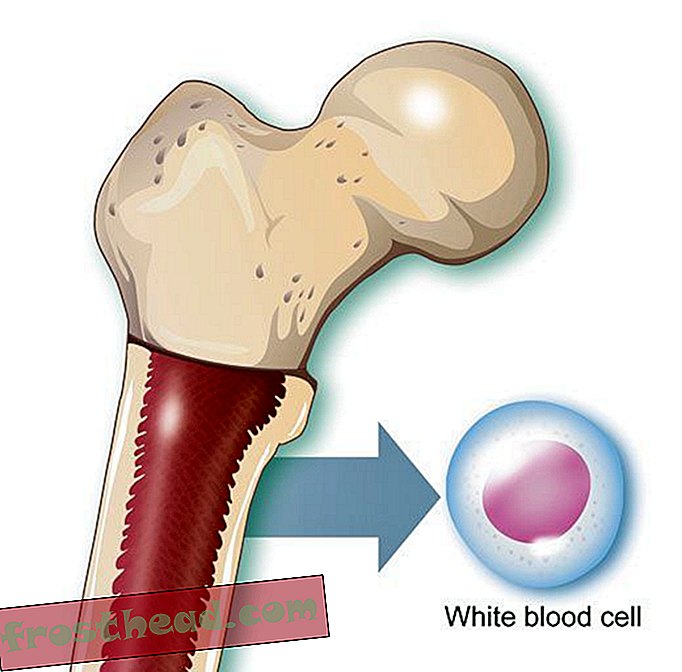 Hvad der forårsager en dødbringende blodkræft br> Celleproduktion br> I knoglemarv producerer nogle stamceller ildbærende røde corpuskler, mens andre skaber hvide celler eller leukocytter, som for det meste heler skader og bekæmper infektion. Et inficeret sår pus er stort set hvidt af leukocytter. (Illustration til Smithsonian )
Hvad der forårsager en dødbringende blodkræft br> Celleproduktion br> I knoglemarv producerer nogle stamceller ildbærende røde corpuskler, mens andre skaber hvide celler eller leukocytter, som for det meste heler skader og bekæmper infektion. Et inficeret sår pus er stort set hvidt af leukocytter. (Illustration til Smithsonian ) 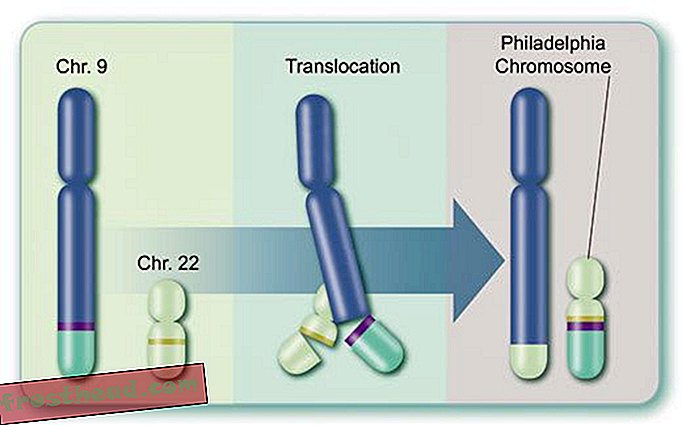 Kromosomer ved et uheld krydser stier br> CML opstår, når en stamcelle fejler sig under opdelingen. I stedet for at de 23 kromosompar bliver nøjagtigt duplikeret, skifter bit af kromosomer nr. 9 og nr. 22 pladser, hvilket skaber et afvigende "Philadelphia-kromosom", der bærer et mutant gen. (Illustration til Smithsonian )
Kromosomer ved et uheld krydser stier br> CML opstår, når en stamcelle fejler sig under opdelingen. I stedet for at de 23 kromosompar bliver nøjagtigt duplikeret, skifter bit af kromosomer nr. 9 og nr. 22 pladser, hvilket skaber et afvigende "Philadelphia-kromosom", der bærer et mutant gen. (Illustration til Smithsonian ) 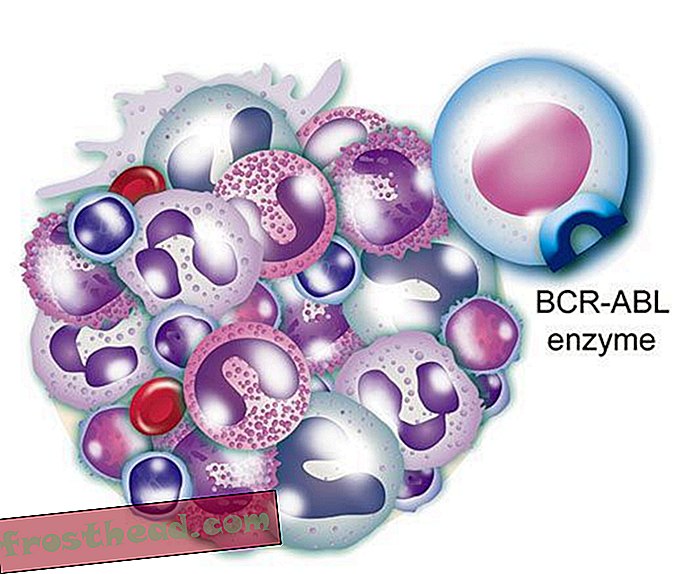 Et lægemiddel, der rammer målet br> Det mutante gen fremstiller et renegadeenzym med samme navn, BCR-ABL. Det ansporer løbende opdeling af hvide blodlegemer eller leukæmi. (Illustration til Smithsonian )
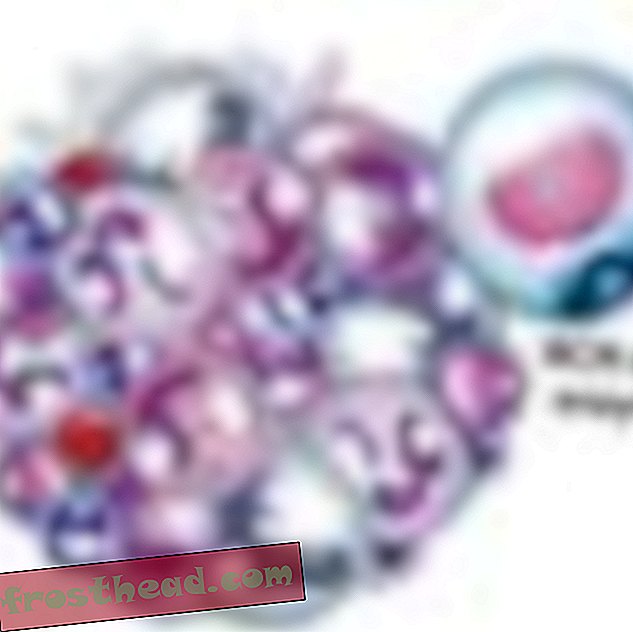
Et lægemiddel, der rammer målet br> Det mutante gen fremstiller et renegadeenzym med samme navn, BCR-ABL. Det ansporer løbende opdeling af hvide blodlegemer eller leukæmi. (Illustration til Smithsonian ) 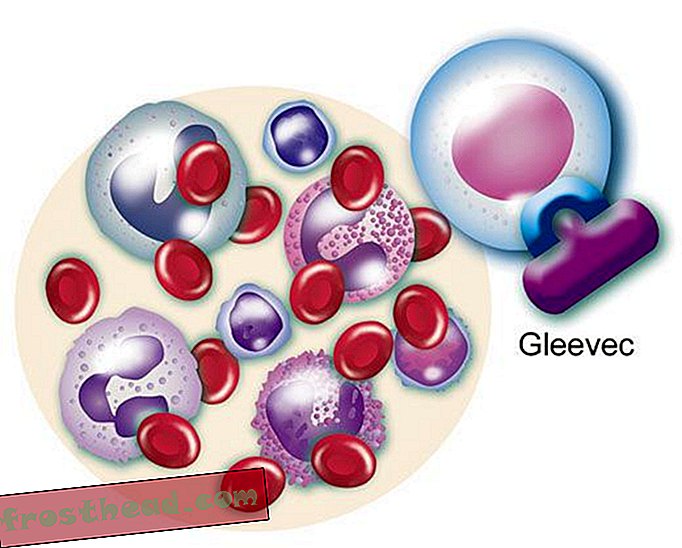 Et lægemiddel, der rammer målet br> CML-medikamentet Gleevec blokerer det enzymlås-og-nøglemode inden i cellen, hvilket gendanner den normale vækst i hvide celler. (Illustration til Smithsonian )
Et lægemiddel, der rammer målet br> CML-medikamentet Gleevec blokerer det enzymlås-og-nøglemode inden i cellen, hvilket gendanner den normale vækst i hvide celler. (Illustration til Smithsonian )














